Ausgangssituation
Kollagenbasierte Biomaterialien werden häufig in der regenerativen Medizin zur Heilung von Gewebedefekten eingesetzt (z. B. bei der Behandlung von Wunden, zur Stillung von Blutungen, zur Rekonstruktion von Knochen- und Knorpelschäden). Die Zusammensetzung der Materialien aus den verschiedenen Kollagentypen beeinflusst den Heilungserfolg und ist ein wichtiges Kriterium für die Marktzulassung eines kollagenbasierten Medizinproduktes.
Projektziel
Im Projekt sollten spezifische Massenspektrometrie-Assays (MRM-Assays) entwickelt werden, die eine Bestimmung der relativen Anteile von Kollagen der Typen I, II und III in Biomaterialien ermöglichen. Die Assays sollten für fünf häufig zur Kollagengewinnung verwendete Spezies (H. sapiens, B. taurus, S. scrofa, E. caballus, O. aries) nutzbar sein.
Lösungsweg
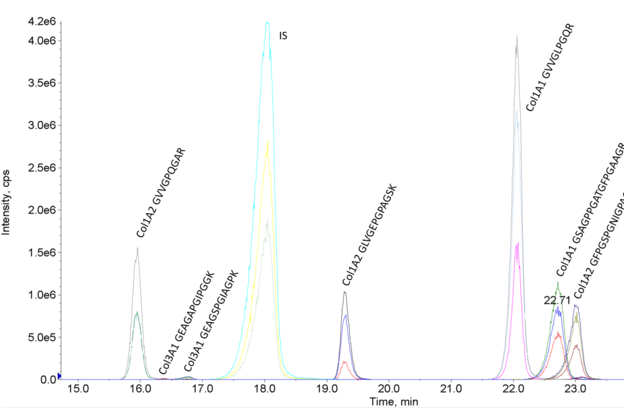
Die Kollagene wurden durch enzymatischen Verdau aus dem Material herausgelöst und die dabei entstehenden Peptide aufgereinigt. In den MRM-Assays sollten anschließend drei Peptid-Ionen mit jeweils drei Fragment-Ionen pro Kollagentyp und Spezies gemessen werden. Ein Peptid wird für die Quantifizierung genutzt, die anderen beiden dienen der sicheren Identifizierung. Die Auswahl der Peptide erfolgte nach bestimmten Kriterien: sie müssen stabil modifiziert und proteotypisch sein, d. h. sie dürfen nicht in anderen Proteinen vorkommen. Um ein optimales Signal für jedes Peptid zu erhalten, mussten peptidspezifische Geräteparameter des Massenspektrometers optimiert werden (z. B. die Kollisionsenergie zur Peptid-Ionenfragmentierung). Zur Quantifizierung wurden die Flächen unter den Peptidpeaks im Ionenchromatogramm integriert. Mit speziell für das Projekt synthetisierten Standardpeptiden wurden auf die gleiche Weise Kalibrierkurven erstellt und zur Berechnung der Peptidmengen genutzt. Anhand der ermittelten Peptidmengen wurde auf die Kollagentypen-Zusammensetzung der Produkte geschlossen.
Ergebnisse | Nutzen
Zunächst wurden zahlreiche MS/MS-Messungen kollagenbasierter Proben durchgeführt und anschließend Peptide, die konstant detektiert werden konnten, für die MRM-Assays ausgewählt. Insgesamt wurden 20 MRM-Assays entwickelt (getrennt nach Kollagentyp und Spezies). Nach Optimierung der Mess- und Geräteparameter wurden diese zu einem Assay pro Spezies zusammengefasst. Im Ergebnis des Projektes liegen damit fünf MRM-Assays vor, mit denen die Kollagentypen I, II und III in Materialien aus den oben erwähnten Spezies gemessen werden können.
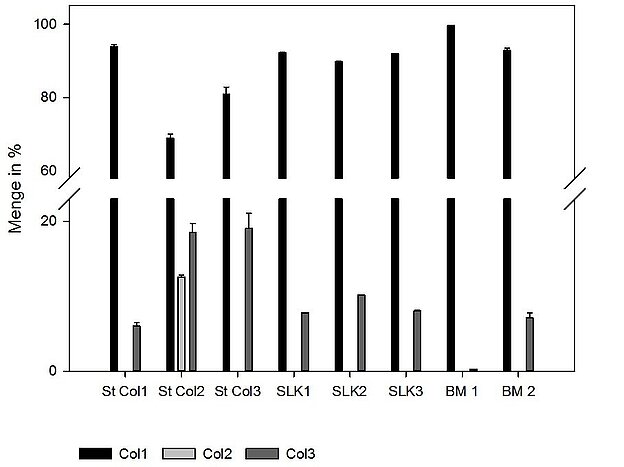
Um die Anwendbarkeit der Assays auf Materialproben zu prüfen, wurde die relative Kollagentypen-Zusammensetzung von Materialien bestimmt. Die rechte Abbildung zeigt beispielhaft die Ergebnisse für verschiedene Proben von B. taurus, darunter kommerziell verfügbare Kollagenstandards, eigene Kollagenpräparationen aus Kalbshaut und am Markt befindliche Biomaterialien. Entgegen den Herstellerangaben bestehen alle drei Standards hauptsächlich aus Kollagentyp I. Daneben wurde in allen Standards auch Typ III gefunden. Kollagentyp II wurde nur im Typ II-Standard gefunden. Die untersuchten Biomaterialien bestehen ebenfalls aus den Kollagentypen I und III. Der prozentuale Anteil von Typ III ist aber unterschiedlich. Um zu prüfen, ob die gemessenen Kollagentypen-Anteile korrekt sind, wurde das Verhältnis der alpha-Ketten des Kollagentyp I bestimmt. Das ist bekannt und sollte in etwa 2 (α1) : 1 (α2) betragen. Dies konnte für die Proben gezeigt werden.
Dank
Das Forschungsvorhaben „Kollagenquantifizierung mittels Massenspektrometrie“, Reg.-Nr.: 49MF200008 wurde anteilig vom Bundesministerium für Wirtschaft und Klimaschutz (BMWK) aufgrund eines Beschlusses des Deutschen Bundestages innerhalb des Förderprogramms „FuE-Förderung gemeinnütziger externer Industrieforschungseinrichtungen – Innovationskompetenz (INNO-KOM) – Modul Marktorientierte Forschung und Entwicklung (MF)“ über den Projektträger EuroNorm GmbH gefördert. Wir bedanken uns für die gewährte Unterstützung.