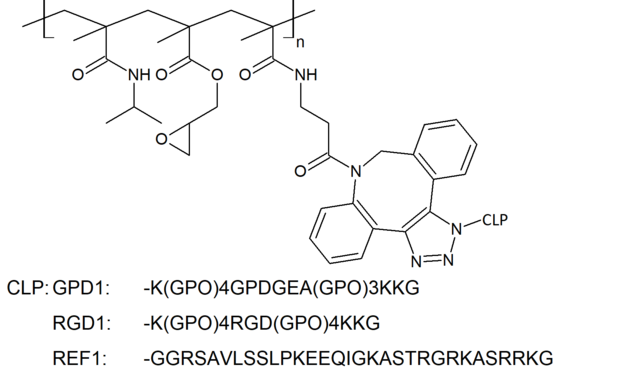Ausgangssituation
In biomedizinischen Anwendungen gewinnen kollagenbasierte Produkte aufgrund ihrer hervorragenden Biokompatibilität und geringen Antigenität zunehmend an Bedeutung. Diese Produkte sind vor allem für kurzzeitige und mittelfristige Anwendungen geeignet, da Kollagen im menschlichen Körper resorbierbar ist und auch keine Abstoßungsreaktionen zu erwarten sind. Natives Kollagen ist insbesondere in feuchtem Milieu nicht mechanisch stabil. Es ist tierischen Ursprungs, was ethische, epidemiologische oder religiöse Bedenken hervorrufen kann. In dem Forschungsvorhaben sollte ein Material entwickelt werden, welches die Vorteile eines reinen Kollagenprodukts (Biokompatibilität, Resorbierbarkeit, Zellaffinität) mit denen eines synthetischen, biokompatiblen Polymers vereint. Dafür sollten synthetische Kollagenpeptide (Collagen like peptides, CLP), die unabhängig von natürlichen Rohstoffquellen sind, mit einer polymeren Acrylatmatrix verbunden werden, die die notwendige mechanische Stabilität verbessert.
Projektziel
Es sollte ein biokompatibles Polymer synthetisiert werden, das sich durch additive Fertigungsverfahren verarbeiten lässt und an das Kollagenpeptide angebunden werden können. Die Kollagene sollten synthetisch hergestellt werden. Die Aminosäuresequenz sollte so gewählt werden, dass eine optimale Akzeptanz der Zellen erreicht werden kann.
Lösungsweg
Ein wesentlicher Schwerpunkt lag auf der Synthese von acrylat- sowie acrylamidbasierten Copolymeren. Die Polymere bestanden jeweils aus drei verschiedenen Monomereinheiten, die verschiedene Funktionen erfüllten. Neben den grundgerüstbildenden Monomeren wurden Monomere mit Epoxyeinheit als Vernetzungspunkt, mit Hydroxyeinheit zur Polaritätserhöhung und mit Anknüpfungspunkten zur Peptidkopplung eingesetzt.
Für die spätere Ankopplung von CLP an die Polymere wurden Cyclooctine in das Polymer integriert. Die Azidfunktionalität der CLPs reagierte mit der Cyclooctingruppe im Polymer in einer Klickreaktion, der Azid-Alkin-Cycloaddition.
Um die kovalente Ankopplung mittels Klickchemie zu ermöglichen, wurden von Kollagen abgeleitete Peptidsequenzen definiert und durch kommerzielle Anbieter hergestellt. Die CLPs sollten die für die Kopplung notwendige Azid-Funktion und das für Kollagen typische Triplett Glycin-Prolin-Hydroxyprolin enthalten. Das Triplett kann eine Tripelhelix ausbilden, welche insbesondere für die Zellaffinität Bedeutung hat.
Ein weiterer wesentlicher Schwerpunkt war die Klickreaktion zwischen Polymer und CLP. Dafür erfolgte zunächst die Klickreaktion eines Modellmoleküls mit dem Polymer. Als Modellsubstanz kam ein azidfunktionalisiertes Polyethylenglycol (PEG) zum Einsatz. Danach erfolgte die Klickreaktion mit den synthetisierten CLPs.
Ergebnisse | Nutzen
Es wurden fünf Polymere unterschiedlicher Monomerkombinationen synthetisiert. Von diesen wurden jeweils mehrere Ansätze hergestellt, wobei die angestrebte theoretische Molmasse sowie das Einbauverhältnis der Monomere zueinander variiert wurde. Mittels Gelpermeationschromatographie (GPC) wurden Molmassen (Mw) zwischen 9.400 g/mol und 281.600 g/mol und Dispersitäten zwischen 1,3 und 2,0 ermittelt. Dispersitäten über 1,5 deuten auf ein eher unkontrolliertes Kettenwachstum hin. Für die Strukturuntersuchung der Polymere hinsichtlich der Einbauverhältnisse der Monomere wurde die Kernspinresonanzspektroskopie verwendet. Trotz der Überlagerung einiger Signale in den ¹H-NMR-Spektren konnten prinzipiell die angestrebten Einbauverhältnisse in synthetisierten Polymeren nachgewiesen werden.
Die Einführung der für die Kopplung notwendigen Cyclooctinfunktionalität sollte entweder über eine Amingruppe oder über einen Hydroxysuccinimidester erfolgen. Die Amingruppe war hierbei zunächst durch eine Boc-Schutzgruppe geschützt, damit bei der Polymerisation keine unerwünschten Nebenreaktionen auftreten konnten. Da die Abspaltung der Boc-Schutzgruppe trotz zahlreicher Variationen der Reaktionsbedingungen nicht zufriedenstellend erfolgte, wurde die Octinfunktionalität in die Polymere über den Hydroxysuccinimidester integriert. Dieser Ester bringt zusätzlich den Vorteil, dass keine Schutzgruppe notwendig war und der Schritt der Abspaltung entfiel.
Die Synthesen der CLPs, insbesondere jener mit den kollagentypischen Tripletts, waren sehr anspruchsvoll. Verschiedenen Anbietern war es nicht möglich, die beauftragten Peptide in der gewünschten Reinheit und Menge herzustellen. Die hauptsächlichen Schwierigkeiten bestanden in der ungenügenden Reinheit, geringen Ausbeute, schlechten Löslichkeit und instabilen Azidfunktion. Aufbauend auf diesen Ergebnissen wurden abgewandelte Aminosäuresequenzen definiert, die durch den Einbau polarer Aminosäuren, wie Lysin, eine verbesserte Löslichkeit aufweisen sollten. Zudem wurden Peptide gewählt, die an zentraler Stelle Sequenzabschnitte enthalten, die aus der Literatur als Erkennungssequenzen für zelluläre Rezeptoren bekannt sind. Sie sind somit einerseits kollagenrelevant. Andererseits brechen sie die einförmige Abfolge der Gly-Pro-Hyp-Tripletts auf, was sich auf die Synthese vorteilhaft auswirken sollte. Am Ende waren drei verschiedene Peptide realisierbar. Es wurden zwei CLPs mit (teilweise im Vergleich zu Literaturangaben abgewandelten) Erkennungssequenzen sowie ein Peptid mit einer Zufallssequenz ohne Kollagenbezug als Referenzmaterial hergestellt.
Die Klickreaktion zwischen Polymer und CLP erfolgte mit einem ausgewählten Polymer (P5-d), welches aus den Monomeren N-Isopropylacrylamid (NIPAm), Glycidylmethacrylat (GMA) und Methacrylsäure-N-hydroxysuccinimidester (MAA-NHSE) aufgebaut war. Die Kopplung erfolgt zwischen P5-d und jeweils allen drei erhaltenen CLPs: GPD1, RGD1 und REF1 (Abbildung 1). Die Ausbeuten der erhaltenen Polymer-Kollagen-Hybridmaterialien waren sehr gering und wurden ausschließlich für IR-Spektroskopie und DSC-Messungen eingesetzt.
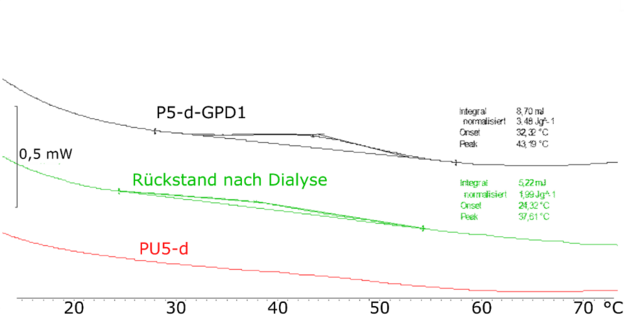
In den DSC-Kurven des Kollagen-Polymer-Hybrids P5-d-GPD1 (Abbildung 2, schwarze Kurve) ist ein schwach ausgebildeter Peak erkennbar. Das deutet darauf hin, dass die Peptide im Hybridmaterial keine stark ausgebildete Tripelhelix ausbilden können. Es ist zu vermuten, dass es zu einer Klickreaktion gekommen war. Diese war nicht vollständig oder mit ausreichender Ausbeute, so dass sich nicht genug Peptide an dem Polymer befinden, um eine Tripelhelix auszubilden. Die IR-Spektren der Kollagen-Polymer-Hybride indizieren, dass bei mindestens zwei von drei CLPs die Klickreaktion erfolgreich verlaufen war.
Insgesamt zeigten die Ergebnisse, dass die Klickreaktion zwischen Polymer und CLP prinzipiell möglich war und auch, dass die Reaktion abhängig von der Struktur des CLPs zu sein scheint.
Danksagung
Das Forschungsvorhaben „Kollagen-Polymer-Hybridmaterialien“, Reg.-Nr.: 49VF190015 wurde anteilig vom Bundesministerium für Wirtschaft und Klimaschutz (BMWK) aufgrund eines Beschlusses des Deutschen Bundestages innerhalb des Förderprogramms „FuE-Förderung gemeinnütziger externer Industrieforschungseinrichtungen – Innovationskompetenz (INNO-KOM) – Modul Vorlaufforschung (VF)“ über den Projektträger EuroNorm GmbH gefördert. Wir bedanken uns für die gewährte Unterstützung.